11.6 Jenis Kristal
Kristal dapat
diklasifikasikan menjadi empat jenis: ionik, kovalen, molekul, atau logam.
Kristal ionik
memiliki dua
karakteristik penting: (1) Mereka terdiri dari muatan spesies (2) ukuran anion
dan kation umumnya sangat berbeda.
Gambar menunjukkan struktur kristal dari tiga senyawa
ionik: CsCl, ZnS, dan CaF2.
Sebagian besar
kristal ionik memiliki titik leleh yang tinggi, indikasi kohesif yang kuat Pasukan
memegang ion bersama-sama. Ukuran stabilitas kristal ion adalah energi kisi;
semakin tinggi energi kisi, semakin stabil senyawa. Padatan ini tidak
menghantarkan listrik karena ion-ionnya tetap pada posisinya. Namun, dalam
keadaan cair (yaitu, ketika meleleh) atau larut dalam air, itu ion bebas
bergerak dan cairan yang dihasilkan konduktif secara listrik.
Kristal Kovalen
Dalam kristal
kovalen, atom disatukan dalam jaringan tiga dimensi yang luas seluruhnya oleh
ikatan kovalen. Contoh terkenal adalah dua alotrop karbon: berlian dan grafit.
Dalam berlian, masing-masing atom karbon adalah hibridisasi sp3; itu terikat
pada empat atom lainnya. Ikatan kovalen yang kuat dalam tiga dimensi
berkontribusi pada kekerasan berlian yang tidak biasa (itu adalah bahan yang
paling sulit diketahui) dan titik leleh yang sangat tinggi (3550 ° C).
Kristal Molekul
Dalam kristal
molekul, titik kisi ditempati oleh molekul, dan menarik gaya di antara mereka
adalah gaya van der Waals dan / atau ikatan hidrogen. Sebuah contoh kristal
molekul adalah sulfur dioksida padat (SO2), di mana yang paling menarik kekuatan
adalah interaksi dipol-dipol. Ikatan hidrogen antar molekul terutama bertanggung
jawab untuk memelihara kisi es tiga dimensi. Contoh lain dari kristal molekuler
adalah I2, P4, dan S8. Secara umum, kecuali dalam es, molekul dalam kristal molekuler
dikemas bersama sebagai sedekat mungkin ukuran dan bentuknya. Karena gaya van
der Waals dan hidrogen ikatan umumnya sangat lemah dibandingkan dengan ikatan
kovalen dan ion, molekul kristal lebih mudah pecah daripada kristal ionik dan
kovalen. Memang sebagian besar kristal molekul mencair pada suhu di bawah 100 °
C.
Kristal Logam
Dalam arti
tertentu, struktur kristal logam adalah yang paling sederhana karena setiap
titik kisi dalam kristal ditempati oleh atom dari logam yang sama. Kristal
logam umumnya kubik berpusat tubuh, kubik berpusat pada wajah, atau heksagonal
yang penuh sesak. Akibatnya, unsur logam biasanya sangat padat. Ikatan dalam
logam sangat berbeda dari ikatan pada jenis kristal lainnya. Di sebuah logam,
elektron ikatan terdelokalisasi di atas seluruh kristal. Bahkan, logam atom
dalam kristal dapat dibayangkan sebagai susunan ion positif yang terbenam di lautan
elektron valensi terdelokalisasi. Kekuatan kohesif yang hebat dihasilkan dari delokalisasi
bertanggung jawab atas kekuatan logam. Mobilitas yang terdelokasi elektron
membuat logam menjadi konduktor panas dan listrik yang baik.
Potongan melintang dari
kristal logam. Masing-masing dilingkari muatan positif mewakili inti dan
elektron bagian dalam sebuah atom logam. Area abu-abu mengelilingi logam
positif ion menunjukkan laut bergerak elektron valensi
11.7
Padatan Amorf
Padatan paling
stabil dalam bentuk kristal. Namun, jika padatan terbentuk dengan cepat (untuk
misalnya, ketika cairan didinginkan dengan cepat), atom atau molekulnya tidak
punya waktu untuk menyelaraskan diri dan mungkin menjadi terkunci di posisi yang biasa disebut kristal. Padatan yang dihasilkan dikatakan amorf. Padatan
amorf, seperti kaca, tidak memiliki susunan atom tiga dimensi yang teratur.
Kaca adalah
salah satu bahan peradaban yang paling berharga dan serbaguna. Itu juga satu
artikel kaca tertua — berasal dari tahun 1000 SM. Kaca biasa disebut produk
fusi yang transparan secara optis dari bahan anorganik yang telah didinginkan
hingga a keadaan kaku tanpa mengkristal. Yang di maksud dengan produk fusi
adalah gelas yang terbentuk dengan mencampur silikon dioksida cair (SiO2),
komponen utamanya, dengan senyawa semacam itu sebagai natrium oksida (Na2O),
boron oksida (B2O3), dan oksida logam transisi tertentu untuk warna dan properti
lainnya.
11.8
Perubahan Fase
Perubahan
fase, transformasi dari satu fase ke fase lainnya, terjadi ketika energi
(biasanya dalam bentuk panas) ditambahkan atau dihapus dari suatu zat.
Perubahan fase adalah perubahan fisik yang ditandaioleh perubahan urutan
molekul; molekul dalam fase padat memiliki yang terbesar ketertiban, dan mereka
yang berada dalam fase gas memiliki keacakan terbesar. Perlu diingat hubungan
antara perubahan energi dan kenaikan atau penurunan urutan molekul akan
membantu kita memahami sifat dari perubahan fisik ini.
Keseimbangan Cairan-Uap
Molekul dalam
cairan tidak tetap dalam kisi yang kaku. Molekul-molekul ini bergerak konstan. Karena cairan lebih padat
daripada gas, laju tumbukan antar molekul jauh lebih tinggi di fase cair dari
pada fase gas. Ketika molekul dalam cairan cukup energi untuk keluar dari
permukaan terjadi perubahan fasa. Pada
gambar menunjukkan kinetik distribusi energi molekul dalam cairan pada dua suhu
yang berbeda. Bisa lihat, semakin tinggi suhunya, semakin besar
energi kinetik, dan karenanya lebih banyak molekul tinggalkan cairannya.
Tekanan Uap
Peralatan
untuk mengukur tekanan uap cairan. (a) Awalnya cairan dibekukan sehingga tidak
ada molekul dalam fase uap. (b) Ketika pemanasan aktif, fase cair terbentuk dan
penguapan dimulai. Di kesetimbangan, jumlah molekul yang meninggalkan cairan
sama dengan jumlah molekul yang kembali ke cairan. Perbedaan tingkat merkuri
(h) memberikan tekanan uap kesetimbangan cairan pada suhu yang ditentukan
Ketika cairan
menguap, molekul gasnya memberikan tekanan uap. Pertimbangkan aparatus yang
ditunjukkan pada gambar. Sebelum proses penguapan dimulai, merkuri kadar dalam
tabung manometer berbentuk-U adalah sama. Segera setelah beberapa molekul
meninggalkan cair, fase uap terbentuk. Proses penguapan tidak berlanjut tanpa batas, namun.
Akhirnya, tingkat merkuri menjadi stabil dan tidak ada perubahan lebih lanjut
yang terlihat.
Panas Molar dari Penguapan dan Titik Didih
Ukuran
kekuatan gaya antarmolekul dalam cairan adalah panas molar penguapan (DHvap),
didefinisikan sebagai energi (biasanya dalam kilojoule) yang diperlukan untuk
menguap 1 mol cairan. Panas molar penguapan berhubungan langsung dengan
kekuatan gaya antarmolekul yang ada dalam cairan. Jika tarikan antarmolekul
kuat, dibutuhkan banyak energi untuk membebaskan molekul dari fase cair dan
panas molar penguapan akan tinggi. Cairan semacam itu juga akan memiliki
tekanan uap yang rendah.
Peningkatan
tekanan uap dengan suhu untuk tiga cairan. Mendidih normal titik cairan (pada 1
atm) adalah ditunjukkan pada sumbu horizontal. Itu ikatan logam yang kuat dalam
merkuri menghasilkan uap yang jauh lebih rendah tekanan cairan di kamar suhu.
Suhu dan Tekanan Kritis
Setiap zat
memiliki suhu kritis (Tc), di atas yang fase gasnya tidak bisa dibuat untuk
mencairkan, tidak peduli seberapa besar tekanan yang diberikan. Ini juga yang
tertinggi suhu di mana suatu zat bisa ada sebagai cairan. Dengan kata lain, di
atas suhu kritis tidak ada perbedaan mendasar antara cairan dan gas. Tekanan kritis (Pc) adalah tekanan minimum yang harus
diterapkan untuk membawa pencairan pada suhu kritis. Gambar menunjukkan apa yang terjadi ketika sulfur hexafluoride dipanaskan
di atas suhu kritisnya (45,5 ° C) dan kemudian didinginkan turun ke bawah 45,5
° C.
Fenomena
kritis sulfur hexafl uoride. (A) Di bawah suhu kritis fase cair jernih
terlihat. (b) Di atas suhu kritis fase cair telah hilang. (c) Zat tersebut
didinginkan tepat di bawah suhu kritisnya. Kabut mewakili kondensasi uap. (d)
Akhirnya, fase cair muncul kembali.
Ekuilibrium Cair-Padat
Transformasi
cairan menjadi padat disebut pembekuan, dan proses sebaliknya disebut mencair,
atau fusi. Titik leleh benda padat atau titik beku cairan adalah titik lelehnya
suhu di mana fase padat dan cair hidup berdampingan dalam kesetimbangan.
Pencairan normal Titik (atau pembekuan) suatu zat adalah suhu saat zat meleleh
(atau membeku) pada tekanan 1 atm.
Kesetimbangan Uap-Padat
Sublimasi
adalah proses di mana molekul pergi langsung dari padatan ke uap tahap.
Deposisi adalah proses kebalikannya, yaitu molekul membuat transisi dari
menguap menjadi padat secara langsung.
Berbagai
fase sehingga suatu zat dapat mengalamiperubahan.
11.9 Diagram Fase
Diagram fase merangkum kondisi di
mana suatu zat ada sebagai padatan, cairan, atau gas. Di bagian ini kita akan
membahas secara singkat diagram fase air dan karbon dioksida.
Air
(a) (b)
Gambar (a) Fase diagram air.
Setiap garis padat antara dua fase yang ditentukan kondisi tekanan dan suhu di
mana keduanya fase bisa ada dalam kesetimbangan. Titik di mana ketiganya fase
bisa ada dalam kesetimbangan (0,006 atm dan 0,01 ° C) disebut titik tripel. (B)
Fase ini diagram memberitahu kita bahwa peningkatan tekanan pada es menurunkannya titik leleh dan
peningkatan itu tekanan air cair meningkat titik didihnya
Diagram fase
memungkinkan kita memprediksi perubahan titik leleh dan titik didih titik zat
sebagai akibat dari perubahan tekanan eksternal; kita juga bisa mengantisipasi
arah transisi fase yang disebabkan oleh perubahan suhu dan tekanan. Titik leleh
normal dan titik didih air pada 1 atm adalah 0 ° C dan 100 ° C,
Karbon dioksida
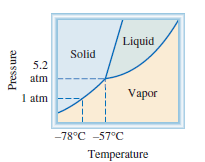
Gambar Fase diagram
karbon dioksida. Catatan bahwa garis batas padat-cair memiliki kemiringan
positif. Cairan fase tidak stabil di bawah 5,2 atm, sehingga hanya padat dan
menguap fase bisa ada di bawah kondisi atmosfer.
Diagram fase
karbon dioksida umumnya mirip dengan air, dengan satu pengecualian penting kemiringan
kurva antara padat dan cair positif. Bahkan, ini berlaku untuk hampir semua zat
lainnya. Air berperilaku berbeda karena es kurang padat daripada air cair.
Titik rangkap karbon dioksida pada 5.2 atm dan 257 ° C.
Pengamatan
yang menarik dapat dilakukan tentang diagram fase pada Gambar. Seperti yang terlihat,
seluruh fase cair terletak jauh di atas tekanan atmosfer; karena itu, tidak
mungkin karbon dioksida padat meleleh pada 1 atm. Sebaliknya, ketika CO2 padat
adalah dipanaskan hingga 278 ° C pada 1 atm, itu menyublim. Faktanya, karbon
dioksida padat disebut es kering karena terlihat seperti es dan tidak meleleh.
Karena properti ini, es kering bermanfaat sebagai pendingin.
..










Tidak ada komentar:
Posting Komentar